
Tema Mezcla de Gases. Presión parcial. Gases ideales
Enunciado . 1) En un recipiente de 2 litros de capacidad se recogen 5 litros de oxigeno medidos a presion de 2 atm, y 10 litros de nitrogeno a la presion de 4 atm. Se dejan salir 25 litros de la mezcla gaseosa a la presion de 1 atm. Calcular: a) la presion final en el recipiente b) el peso del oxigeno y de nitrogeno contenidos al final de dicho recipiente.

11) En un recipiente de 1 L, a 2 atm de presión y 300 °K
11) En un recipiente de 1 L, a 2 atm de presión y 300 °K de temperatura, hay 2,6 g de un gas. ¿Cuál es la masa molecular del gas? 12) La ley de Boyle establece que la presión y el volumen de un sistema gaseoso son inversamente proporcionales.

Ajuste de ecuaciones químicas Ajuste Online
¡Ayúdanos hablando de este software químico a tus amigos! Enlace directo a esta ecuación ajustada: Instrucciones sobre equilibrio de ecuaciones químicas: Escribe una ecuación de una reacción química y pulsa el botón Balancear. La respuesta aparecerá abajo.

LIQUIDACIÓN DE OXIGENO by luis alejandro hernandez on Prezi
OXIGENO La unidad de medida utilizada para la facturación del suministro de oxigeno en los servicios de internación o ambulatorios es el metro cubico (M3). El Seguro Social reconocerá el valor del consumo por hora o fracción igual o superior de treinta minutos. Para la obtención

(CO2). Este gas se combina fácilmente con los glóbulos
2 (CO2). Este gas se combina fácilmente con los glóbulos rojos de la sangre cuado se respira produciendo asfixia. Con mezclas pobres el porcentaje de CO se mantiene por debajo de 0,5 %.Los valores mínimos se consiguen con coeficientes de aire igual a 1,1.

Completa El Siguiente Esquema De La Combinacion Del
los metales alcalinos: son aquellos que están situados en el grupo IA de la tabla periódica (excepto el Hidrógeno que es un gas). Todos tienen un solo electrón en su nivel energético más externo, con tendencia a perderlo (esto es debido a que tienen poca afinidad electrónica, y baja energía de ionización), con lo que forman un ion mono
![[3 ][ ]](/dm-content/proimg/15.jpg)
[3 ][ ]
El valor de la constante de equilibrio Kc para la reacción H 2 (g) + F 2 (g) 2HF (g), es 6,6×10 4 a 25 ºC. Si en un recipiente de 10 L se introduce 1 mol de H 2 y 1 mol de F 2, y se mantiene a 25 ºC hasta alcanzar el equilibrio, calcule: a) Los moles de H 2 que quedan sin reaccionar una

solucionario del cap. 2 de robert TREYBAL SlideShare
solucionario del cap. 2 de robert TREYBAL 1. 2.1 En una mezcla gaseosa de oxigeno nitrógeno a 1atm., 25 ºC, las concentraciones del oxígeno en dos planos separados 2 mm son 10 y 20% en vol., respectivamente. Calcular el flux de difusión del oxígeno para el caso en que: a) El nitrógeno no se está difundiendo.

OPCIÓN A (g), 7 moles de O (g) y
OPCIÓN A CUESTIÓN 4. Se tienen tres depósitos cerrados A, B y C de igual volumen y que se encuentran a la misma temperatura. En ellos se introducen, respectivamente, 10 g de H 2 (g), 7 moles de O 2 (g) y 10 23 moléculas de N 2 (g). Indica de forma razonada:

Cuantos gramos de oxigeno se liberan al aire en esta
mol × 180 g/mol = de C6H12O6 La segunda pregunta es, cuantos gramos de oxigeno se liberan al aire, si tenemos 3,250g de CO2? De nuevo miremos la reacción 6CO2 + 6H2O = C6H12C6 + 6O2 6 moles producen 6 moles de oxigeno. Es decir, la misma cantidad, por lo tanto. 1 mol de CO2 = 1 mol O2 Entonces se liberan 0.07386mol de O2.








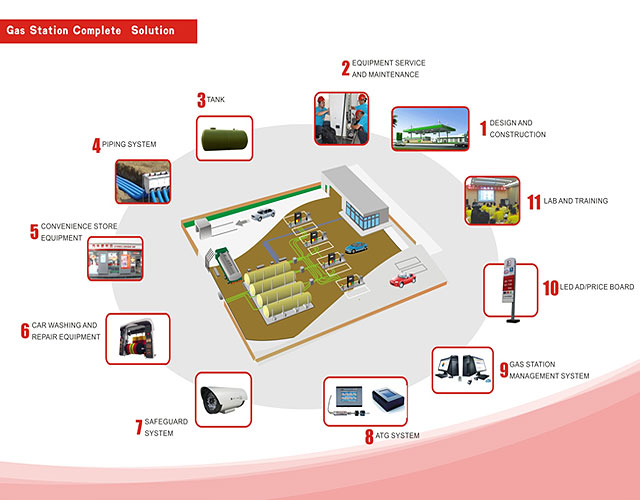
 Message
Message tel
tel Inquiry
Inquiry